Du nom du premier satellite (russe) de la terre, ce premier vaccin contre le nouveau coronavirus SARS-CoV-2, autorisé en « fast track » suscite déjà une grande inquiétude au sein de la communauté de recherche internationale, en particulier sur sa sécurité. Pour cause, approuvé en Russie pour une utilisation en population générale, Spoutnik V n’a pas encore terminé ses essais de phase III, une étape incontournable qui achève normalement le processus d’évaluation d’un nouveau vaccin ou d’un nouveau médicament avant obtention de son autorisation de mise sur le marché.
L’annonce effectuée le 11 août de cette approbation en population générale, par le Président russe Vladimir Poutine, est condamnée par les scientifiques du monde entier qui s’inquiètent d’une insuffisance possible d’efficacité et d’innocuité du vaccin qui non seulement discréditerait les autres vaccins en cours de développement mais affaiblirait encore un peu plus l’image de la vaccination. «Le fait que les Russes sautent les étapes inquiète notre communauté de spécialistes des vaccins », commente, dans la revue Nature, le Dr Peter Hotez, spécialiste des vaccins au Baylor College of Medicine de Houston.
« Une décision imprudente et insensée »
La vaccination de masse avec un vaccin mal testé est contraire à l'éthique. Le candidat russe, Spoutnik V, développé par l'Institut de recherche Gamaleya en épidémiologie et microbiologie à Moscou, vient en effet d’être approuvé par l’Agence sanitaire russe alors que les essais de phase III sont toujours en cours. Pourtant cette dernière phase de validation est indispensable pour valider, autant que possible et vs placebo, l’efficacité et la sécurité (effets secondaires) du candidat, grâce à un très large échantillon et un suivi suffisamment long. Précisément, le candidat a été administré à 76 volontaires dans le cadre de 2 essais cliniques enregistrés au registre des essais cliniques ClinicalTrials.gov, cependant aucun résultat de ces essais ou d'autres études précliniques n'a été publié. Selon le registre ClinicalTrials.gov, le vaccin, administré en 2 doses, est composé de deux adénovirus qui expriment la protéine de pointe du coronavirus, la première dose étant basée sur un adénovirus de sérotype 26 (Ad26) -également utilisé par le Laboratoire pharmaceutique Johnson & Johnson et sa filiale Janssen-, la deuxième dose sur un adénovirus de sérotype 5 (Ad5)- également utilisé par le Laboratoire pharmaceutique CanSino Biologics (Chine)-. Selon les Autorités sanitaires russes, les 38 participants qui ont reçu 1 ou 2 doses du vaccin ont bien produit des anticorps contre la protéine de pointe du SRAS-CoV-2, dont des anticorps neutralisants.
Bien que les essais de phase III ne soient pas achevés, les Autorités ont déjà annoncé la vaccination prioritaire, avec Spoutnik V, des professionnels de santé et des enseignants.
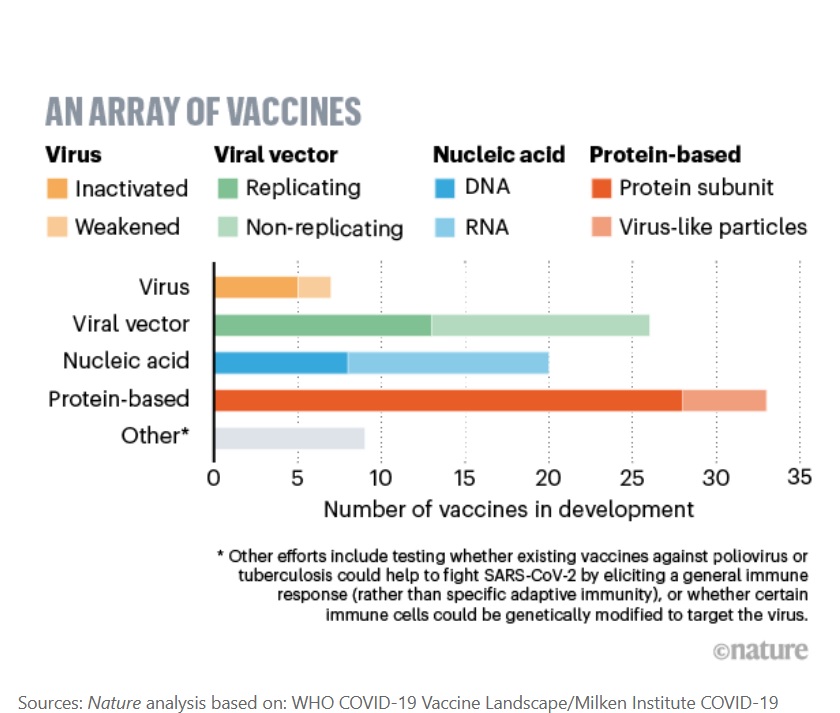
Plus de 200 vaccins COVID-19 sont en cours de développement dans le monde : il existe donc de nombreux autres pistes et cette approbation précipitée peut dès lors être interprétée comme une opération médiatique et politique. D’autant que plusieurs de ces candidats sont déjà en essais de phase III et d'autres sur le point d’y arriver.
4 approches majeures sont poursuivies : si tous les vaccins visent à exposer le corps à un antigène qui ne causera pas la maladie mais provoquera une réponse immunitaire capable de bloquer l’infection ou de tuer le coronavirus, les équipes de recherche peuvent, pour cela, travailler à partir du virus lui-même, à partir de vecteurs viraux, de protéines du virus ou encore directement à partir de l’acide nucléique qui va produire, une fois dans les cellules hôtes, des copies de la protéine virale. Ainsi, parmi les vaccins basés le virus lui-même, sous une forme affaiblie ou inactivée, le candidat de Sinovac (Pékin), basé sur une version inactivée du SRAS-CoV-2 est en cours d’essai de phase III.
2 équipes qui travaillent sur des vaccins à vecteur viral (Université d'Oxford avec AstraZeneca et CanSino Biologics (Chine) ont publié des résultats de phase I/II et II dans le Lancet. Le vaccin d’Oxford exploite un virus qui cause le rhume chez les chimpanzés, génétiquement modifié pour exprimer la protéine « de pointe » que le coronavirus utilise pour infecter les cellules humaines. Le vaccin de CanSino utilise un virus humain modifié de la même manière.
BioNTech (Mayence), développe un vaccin à base d'ARN avec le Laboratoire Pfizer. Le lancement des essais de phase IIb/III a été confirmé fin juillet. Moderna, une biotech de Cambridge, qui a développé un vaccin à base d'ARN messager de la protéine de pointe du virus, entré récemment en phase III, vient d’annoncer son déploiement opérationnel en Europe.
Il reste, en dépit de tous ces essais de phase III qui démarrent ou sont déjà en cours, de nombreuses étapes à franchir. En particulier, apprécier la nature de la réponse immunitaire induite par les différents candidats et ses niveau et durée de protection contre le COVID-19.
Sources:
- Nature 11 August 2020 DOI : 10.1038/d41586-020-02386-2 Russia’s fast-track coronavirus vaccine draws outrage over safety
- Nature (News) 21 July 2020 DOI: 10.1038/d41586-020-02174-y Coronavirus vaccines leap through safety trials — but which will work is anybody’s guess
- The Lancet July 20, 2020 DOI: 10.1016/S0140-6736(20)31605-6 Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial
- The Lancet July 20, 2020 DOI : DOI: 10.1016/S0140-6736(20)31604-4 Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial
Plus sur COVID-19

Laisser un commentaire