Cette étude de neuroscientifiques de l’Institut Picower du Massachusetts Institute of Technology (MIT) remonte à l'émergence de la plaque d'Alzheimer et confirme un début précoce et en profondeur de la maladie dans le cerveau. Ces travaux présentés dans la revue Communications Biology, menés chez la souris modèle, estiment même le début de l’Alzheimer aux tout début de la vie.
La démonstration est faite sur une souris modèle Alzheimer (5XFAD) avec une technologie de pointe « SWITCH », qui permet de constater cette accumulation de plaque amyloïde (en blanc sur visuel), extrêmement tôt et dans les régions profondes du cerveau. Ainsi, comme suggéré dans de nombreuses études, la maladie est bien « là » des années avant l’apparition des premiers symptômes tels que la perte de mémoire. Au moment où ces premiers symptômes sont diagnostiqués, la pathologie sous-jacente de la maladie d'Alzheimer, et l'accumulation de plaques de protéines amyloïdes caractéristique, sont déjà bien avancées dans le cerveau.
Un tout nouvel éclairage sur les tout débuts de la pathogenèse
A la recherche de la source : l’objectif des scientifiques reste toujours le même -et comme dans toutes les maladies neurologiques- pouvoir intervenir, en particulier en regard de l’absence de traitement curatif, de manière précoce et, si possible « à la source » de la pathogenèse. Un objectif à long terme est donc de comprendre où, exactement la maladie commence afin de pouvoir cibler les interventions futures.
L’émergence de la plaque amyloïde est précoce et profonde : cette étude a donc cherché à localiser les zones où l’amyloïde apparaît dans le cerveau, ici d’un modèle murin bien documenté de la maladie. L’étude montre également que le degré d'accumulation d'amyloïde dans une zone équivalente du cerveau humain est fortement corrélé à la progression de la maladie chez l’Homme. « La maladie d'Alzheimer est une maladie neurodégénérative, de sorte que vous pouvez identifier les fortes pertes neuronales », explique Wen-Chin « Brian » Huang, co-auteur principal de l'étude. « À ce stade, les symptômes ne sont pas encore là et il serait difficile de les traiter. Il est donc vraiment essentiel de comprendre quels circuits et quelles zones présentent un dysfonctionnement neuronal au tout début de la maladie ».
De précédentes recherches ont tracé ou tenté de tracer la trajectoire cérébrale de l'amyloïde à l'aide de technologies telles que la tomographie à émission de positrons (PET) et en examinant le cerveau post-mortem, mais cette étude apporte de nouvelles preuves substantielles à partir de ce modèle de souris 5XFAD, car son observation du cerveau commence dès l'âge d'1 mois. L'étude révèle que :
- l'amyloïde commence sa terrible percée dans les zones cérébrales profondes telles que les corps mammillaires, le septum latéral et le subiculum avant de se frayer un chemin le long de circuits cérébraux spécifiques qui l'amènent finalement à l'hippocampe, une zone clé impliquée dans la mémoire, et le cortex, impliqué dans la cognition.
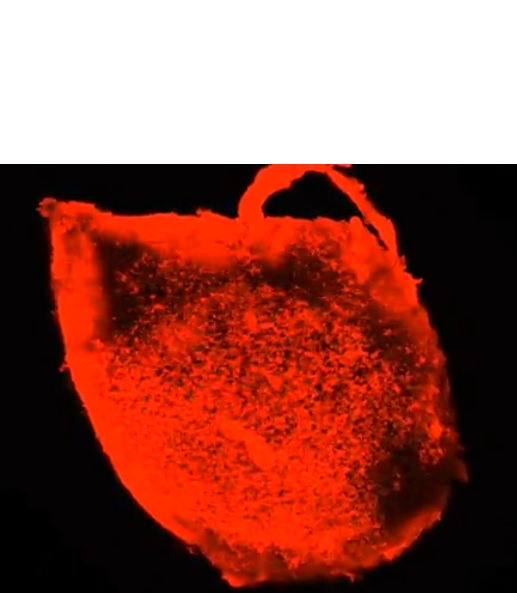
SWITCH, une technologie de pointe développée par l’équipe, pour marquer les plaques d’amyloïde et obtenir une vision claire de l’ensemble du cerveau de souris 5XFAD aux différents âges, a permis d’établir ces nouveaux constats. L’équipe constate que les plaques apparaissent dans les structures cérébrales profondes, puis suivent des circuits spécifiques pour se répandre dans le cerveau au bout de 6 à 12 mois (la durée de vie d’une souris étant de 3 ans) (Visuel ci-contre).
Ces découvertes permettent d’éclairer les processus pathologiques chez l’Homme, bien plus difficiles à cerner, à partir de cerveaux humains, car la dissection post mortem ne permet pas de retracer facilement l'évolution de la maladie et les examens par PET scan n'offrent pas le même type de résolution avancée. D’ailleurs ces découvertes chez la souris sont reproduites et validées sur des tissus humains : si les corps mammillaires sont bien le site d’apparition précoce des plaques amyloïdes, la densité de ces plaques devrait augmenter proportionnellement à la progression de la maladie. Effectivement, lorsque l'équipe utilise SWITCH pour examiner les corps mammillaires de cerveaux humains post-mortem à différents stades de la maladie, elle confirme exactement cette relation : plus le stade de la maladie est avancé, plus le corps mammillaire est envahi de plaques.
Les altérations du cerveau humain dans la maladie d'Alzheimer ressemblent bien à celles observées chez la souris : les auteurs suggèrent ainsi que chez les humains aussi, les dépôts bêta-amyloïdes commencent dans des structures sous-corticales et se développent via des réseaux cognitifs de plus en plus complexes avec l'âge. Enfin, lorsque l’équipe mesure l’excitabilité des neurones dans le corps mammillaire de souris 5XFAD, elle constate que les neurones sont plus excitables que chez des souris saines, un autre signe de la pathogenèse. Et lorsqu’ils réduisent au silence les neurones du corps mammillaire des souris 5XFAD, la production d'amyloïde est réduite.
Ces travaux jettent ainsi une toute nouvelle lumière sur la manière dont l'amyloïde se propage dans le cerveau dans l'espace et dans le temps, mais soulève aussi de nouvelles questions, notamment sur les types de cellules et les circuits les plus affectés au départ. De futures cibles en perspective pour juguler le développement de la maladie.
Source: Communications Biology 04 October 2019 3D mapping reveals network-specific amyloid progression and subcortical susceptibility in mice
Plus sur l’Alzheimer sur Neuro Blog

Laisser un commentaire